
Переход в кристаллическое состояние сопровождается скачкообразным изменением удельного объема, энтальпии, энтропии, вязкости и других свойств. При переходе же из расплавленного состояния в стеклообразное жидкость переохлаждается ниже точки фазового равновесия и ее свойства непрерывным образом изменяются с температурой.
По мере понижения температуры структура расплава непрерывно изменяется. При всех температурах >tg расплав успевает переходить в состояние, соответствующее минимуму свободной энергии при данной температуре. Дальнейшее понижение температуры приводит к уменьшению подвижности частиц из-за нарастания вязкости и увеличению времени релаксации структуры. Ниже tg скорость установления структурного равновесия становится настолько малой, что расплав не успевает релаксировать к своему метастабильному состоянию. Происходит «замораживание» структуры, свойственной ей при более высоких температурах.
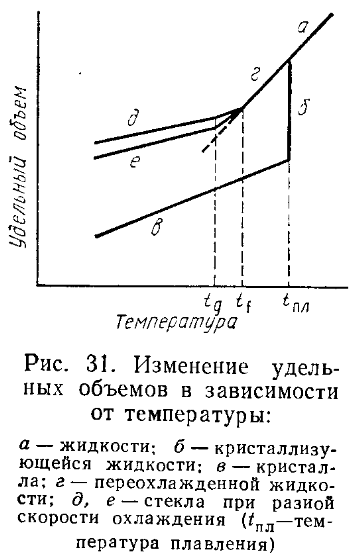 При рассмотрении свойств некоторых стекол используют понятие фиктивной температуры. Она соответствует той температуре, при которой пересекаются кривые изменения объема стекла и переохлажденного расплава. Это понятие позволяет учесть, что охлаждение расплава с различной скоростью, обусловливающее различие во времени релаксации решетки, приводит к образованию стекол с различными структурами, которые эквивалентны строению расплава в разных точках на кривой изменения объема переохлаждения жидкости.
При рассмотрении свойств некоторых стекол используют понятие фиктивной температуры. Она соответствует той температуре, при которой пересекаются кривые изменения объема стекла и переохлажденного расплава. Это понятие позволяет учесть, что охлаждение расплава с различной скоростью, обусловливающее различие во времени релаксации решетки, приводит к образованию стекол с различными структурами, которые эквивалентны строению расплава в разных точках на кривой изменения объема переохлаждения жидкости. Таким образом, стеклование является релаксационным процессом, вследствие чего переход в стеклообразное состояние должен зависеть от скорости охлаждения. Имеется достаточно много экспериментальных данных, подтверждающих такую взаимосвязь.
 Условия стеклообразования, определяемые природой исходных веществ. В. М. Гольдшмидт показал, что некоторые оксиды: SiO2, GeO2, Р2O5 — в кристаллической структуре содержат четырехгранники и предложил считать эту особенность критерием способности к стеклообразованию. Поскольку координационное окружение, согласно Л. Полингу, определяется отношением ионных радиусов rMe : r02-, количественным критерием способности оксида к стеклообразованию является значение отношений радиусов катиона и кислорода в пределах 0,2...0,4, т. е. как раз такое, которое соответствует координационному числу (К. Ч.) =4.
Условия стеклообразования, определяемые природой исходных веществ. В. М. Гольдшмидт показал, что некоторые оксиды: SiO2, GeO2, Р2O5 — в кристаллической структуре содержат четырехгранники и предложил считать эту особенность критерием способности к стеклообразованию. Поскольку координационное окружение, согласно Л. Полингу, определяется отношением ионных радиусов rMe : r02-, количественным критерием способности оксида к стеклообразованию является значение отношений радиусов катиона и кислорода в пределах 0,2...0,4, т. е. как раз такое, которое соответствует координационному числу (К. Ч.) =4. Несколько позднее (1932) В. Захариассен показал, что не каждый оксид, имеющий отношение rMe : ro2-=0,2 ... 0,4, может образовывать стекло. Так, у ВеО отношение радиусов катиона и ионов кислорода обеспечивает К. Ч. = 4, тем не менее оксид бериллия не удается получить в стеклообразном состоянии. В связи с этим В. Захариассеном было сформулировано несколько новых дополнительных требований, необходимых для стеклообразования.

Исходное положение В. Захариассена сводилось к тому, что в стеклах, как и в кристаллах, атомы должны быть увязаны в единую трехмерную сетку. Она должна быть весьма близка к трехмерной пространственной решетке, характерной для кристаллических веществ, отличаясь лишь отсутствием строгой периодичности. Это выполняется тогда, когда координационное окружение в первой координационной сфере будет одинаковым в стекле и кристалле, а стало быть, будут одинаковыми и основные структурные элементы. Однако если в кристалле эти структурные элементы расположены так, что создают правильную трехмерную решетку, то в стекле угловые связи настолько искажаются, что периодичность расположения структурных элементов не выдерживается, и сетка становится хаотичной. Следует, однако, отметить, что энергия такой сетки сравнима с энергией, соответствующей кристаллической решетке.
Условия формирования такой беспорядочной сетки и соответственно критерии стеклообразования по В. Захариассену таковы:
1) каждый ион кислорода должен быть связан не более чем с двумя катионами;
2) координационное число окруженных ионами кислорода центральных катионов должно быть небольшим, не более 4;
3) кислородные многогранники могут связываться друг с другом через общие углы таким образом, что образуются трехмерные пространственные решетки;
4) каждый многогранник должен быть связан с другими по крайней мере тремя общими углами.
Источник: Горшков В.С., Савельев В.Г., Федоров Н.Ф. Физическая химия силикатов и других тугоплавких соединений. — М.: Высш. шк. — 1988. — С. 124.