Утворення іонного зв'язку
Іонний зв'язок виникає за умови, що різниця між значеннями електронегативностей елементів перевищує 1,9. Якщо ж ця різниця менша за 1,9, то зв'язок має ковалентний характер. Наприклад, натрій бурхливо реагує з хлором, внаслідок чого утворюється хлорид натрію, що має іонну кристалічну будову (χCl - χNa = 3,0 - 0,9 = 2,1 > 1,9):
- 2Na(тв.) + Cl2(г.) → 2NaCl(тв.)
- під час взаємодії двох атомів один з них віддає електрон і перетворюється на позитивно заряджений іон (M - 1e- → M+) — катіон, інший атом приєднує електрон і перетворюється на негативно заряджений іон (A + 1e- → A-) — аніон;
- іони з протилежними зарядами електростатично притягуються один до одного й утворюють стійку сполуку з йонним зв'язком.
Хлорид натрію NaCl є типовим прикладом іонної сполуки. Такі процеси перетворення атомів на іони виявляються енергетично вигідними тоді, коли атом, що віддає електрон, має низьку енергію іонізації, а атом, що його приєднує, — велику спорідненість до електрона.
У реакціях, внаслідок яких утворюються сполуки з іонним типом зв'язку, атоми намагаються набути найстійкішої електронної конфігурації. Так, одноатомні аніони F-, Cl-, Br- та деякі катіони (Ka+, A+, Ca2+, Ba2+) мають будову зовнішнього електронного шару атомів найближчого інертного газу (ns2np6).
У складніших випадках утворення катіонів пов'язують з відносним підвищенням стійкості їхніх повністю сформованих енергетичних підрівнів:
Отже, прості катіони найлегше утворюють лужні та лужноземельні метали. Вони мають великі атомні радіуси і низькі значення енергій іонізації I, що лежать у межах 375-520 кДж/моль. На прості одноатомні аніони перетворюються атоми p-елементів VII групи, які мають найбільшу спорідненість до електрона Eсп = 320...350 кДж/моль. Водночас раніше зазначалось, що утворення двох- та багатозарядних одноатомних аніонів типу O2-, S2-, N3- з відповідних однозарядних іонів виявляється енергетично невигідним процесом внаслідок виникнення значних сил електростатичного відштовхування.У реакціях, внаслідок яких утворюються сполуки з іонним типом зв'язку, атоми намагаються набути найстійкішої електронної конфігурації. Так, одноатомні аніони F-, Cl-, Br- та деякі катіони (Ka+, A+, Ca2+, Ba2+) мають будову зовнішнього електронного шару атомів найближчого інертного газу (ns2np6).
У складніших випадках утворення катіонів пов'язують з відносним підвищенням стійкості їхніх повністю сформованих енергетичних підрівнів:
- Ag (4d105s1) → Ag+ (4d10);
- Zn (3d104s2) → Zn2+ (3d10);
- Ga (3d104s24p1) → Ga3+ (3d10);
- Bi (6s26p3) → Bi3+ (6s2).
Згідно з квантово-механічними розрахунками приєднання другого та подальших електронів до атомів неметалів виявляється неможливим, тому одноатомні багатозарядні аніони не можуть уособлено виокремлюватись навіть у кристалічних оксидах типу Na2O чи CaO. Навпаки, існування багатоатомних аніонів типу SO42-, CO32-, PO43- та інших енергетично можливе, оскільки в цьому разі відбувається розподіл надлишку електронів між кількома атомами, що призводить до зменшення на окремих атомах значення негативного заряду.
Властивості іонного зв'язку
В основу іонного зв'язку покладено переважно електростатичну взаємодію між іонами, тому, на відміну від ковалентного, іонний зв'язок характеризується ненапрямленістю та ненасиченістю.
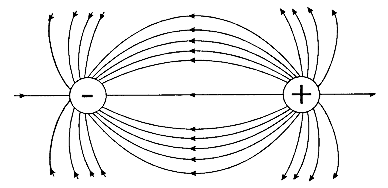
Ненапрямленість іонного зв'язку зумовлена тим, що електричне поле кожного іона, який уявно можна розглядати як заряджену сферу, поширюється у просторі в усіх напрямках.
Ненасиченість іонного зв'язку пов'язана з тим, що в результаті взаємодії двох протилежно заряджених іонів їхні електричні поля компенсуються не повністю, тому можливе притягання цих іонів у інших напрямках. У результаті кожний іон оточує себе іонами протилежного заряду.
Розподіл електричних силових полів двох протилежно заряджених іонів
Сполуки з іонним типом зв'язку у вигляді молекул не існують ні в твердому стані, в якому вони мають іонну кристалічну ґратку, ні в розчині, де вони дисоціюють на іони під впливом полярних молекул розчинника. Нестійкі молекули іонних сполук (NaCl, LiCl та ін.), а також їхні асоціати можна виявити тільки в газовому стані за високих температур.
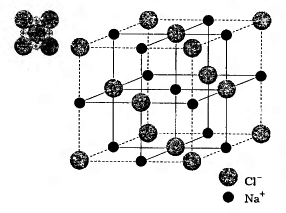
На відміну від ковалентних сполук число координованих (які формують найближче оточення) навколо кожного іона частинок протилежного заряду в іонних кристалах (координаційне число — к. ч.) визначається насамперед не специфікою електронної будови атома елемента, а співвідношенням розмірів іонів, що намагаються оточити себе максимально можливим числом протилежно заряджених частинок. За співвідношення радіусів іонів 0,41-0,73 має місце октаедрична взаємна координація іонів (к. ч. = 6); за співвідношення 0,73-1,37 — кубічна (к. ч. = 8). Наприклад, у кристалічній ґратці NaCl кожен іон натрію оточений шістьма іонами хлору, що мають протилежний заряд (ri(Na+)/ri(Cl-)) = 98 пм/181 пм = 0,53).
Кристалічна ґратка хлориду натрію