Если вы считаете, что химия - это сливание разных растворчиков вместе, то вы в принципе недалеки от истины. Подавляющее число реакций требуют растворителя - в противном случае реагенты не провзаимодействуют или реакция пройдёт не до конца. Существуют исключения (например, твёрдофазный синтез), а также иногда растворителем является один из реагентов. Но сейчас о более классических случаях.
Вода. В отличие от неорганической химии, целый раздел которой посвящён реакциям в водной среде (реакции ионного обмена), в органике далеко не каждый реагент будет растворяться в воде в разумных количествах. В основном в воде ведут реакции с участием неорганических соединений например, реакции окисления). Вода считается относительно химически активной: например, сложные эфиры медленно разлагаются в присутствии воды, не говоря уже об ангидридах кислот, алкоголятах и металлоорганических соединениях. Однако, если в реакции удаётся заменить органический растворитель на воду, то это считается хорошим достижением (особенно в промышленности) и называется "Green Chemistry", поскольку вода впоследствии легко очищается, регенерируется или другим способом утилизируется.
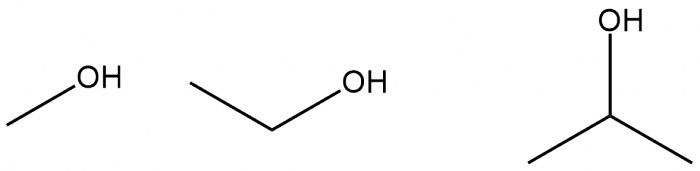
Наиболее близкими к воде по свойствам являются, пожалуй, спирты. Но по сравнению с водой, их растворяющая способность (за исключением неорганики) выше. Спирты так же, как и вода, являются полярными, то есть положительные и отрицательные заряды в молекуле расположены неравномерно. Благодаря этому низшие спирты смешиваются с водой и в той или иной степени растворяют неорганические соединения. Также они растворяют жиры и прочие неполярные соединения. Некоторых случаях спирт сам вступает в реакцию, образуя побочные продукты. Преимуществом низших спиртов является лёгкость их выпаривания (особенно под вакуумом), а изопропанол утягивает с собой при этом ещё порядка 15% воды, что позволяет при необходимости легко удалить воду из раствора в довольно щадящих условиях.
Есть курьёзный случай использования а также других алкогольных напитков – по сути растворов спирта в воде как растворителя в реакции. (см. ссылки)
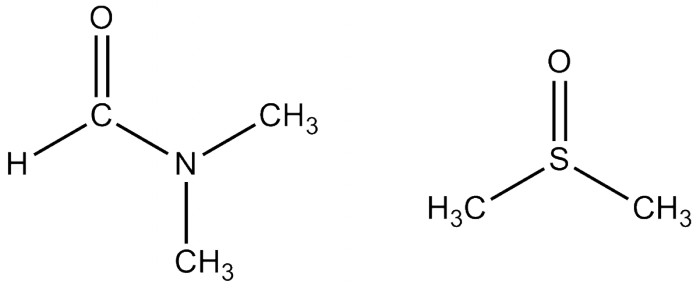
Если нужен полярный растворитель (а от полярности растворителя часто зависит скорость и направление протекания реакции), то также можно взять диметилформамид (ДМФ). Это относительно дешёвый растворитель, производящийся промышленностью в огромных количествах. За счёт отсутствия OH-групп ДМФ более химически инертен и в большинстве случаев может быть нагрет аж до температуры кипения (153°С). Однако высокая температура кипения имеет свои минусы: упаривать его имеет смысл только под вакуумом. Зато ДМФ смешивается с водой, поэтому при выделении продукта часто реакционную смесь выливают в воду и отделяют продукт в виде осадка (для твёрдых и нерастворимых соединений), либо в виде отдельного слоя (если продукт-жидкость), либо экстрагируют из получившегося раствора или эмульсии. Хотя на самом деле ДМФ без проблем отгоняется/перегоняется на роторном испарителе при ~35мм.рт.ст.
Ещё один растворитель, смешивающийся с водой - это ДиМетилСульфОксид (ДМСО). ДМСО в чём-то похож на воду: он сильно полярен, вследствие чего растворяет многие неорганические соли. ДМСО смешивается с водой и удивительно нетоксичен: аптечный препарат "димексид" - это чистый диметилсульфоксид. Некоторые неудобства доставляет его высокая температура кипения (189°С) и удивительно высокая температура замерзания (18°С). В большинстве случаев целевой продукт выделяют так же, как и с ДМФ - разбавляя раствор в несколько раз водой.
ДМСО, однако, представляет некоторую опасность, т.к. растворённые в нём вещества при попадании на кожу могут беспрепятственно всасываться, что нежелательно, когда это токсичные, ядовитые или раздражающие вещества.
Из числа смешивающихся с водой растворителей хочется выделить ТетраГидроФуран, который гораздо менее полярен, чем ДМФ, ДМСО и спирты, но зато более стабилен, поскольку с химической точки зрения является простым эфиром. Кислоты и основания ему нипочём, органику он растворяет отлично (в тяжёлых случаях им можно отмывать посуду, но ДМФ дешевле), при атмосферном давлении кипит при 66°C, что очень удобно. ТГФ - один из немногих растворителей, подходящих для металлорганических соединений (магний- и даже литийорганики). Но он ощутимо дороже большинства растворителей и уже несколько лет считается прекурсором.
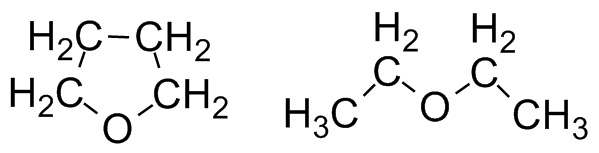
Тетрагидрофуран и диэтиловый эфир
С химической точки зрения ближайшим родственником ТГФ можно назвать диэтиловый эфир. Если говорят "эфир", то обычно именно он и подразумевается. Эфир неполярен (в отличие от ТГФ!) и мало растворяется в воде, что позволяет проводить экстракцию органики из водного раствора. Он очень легко испаряется (Ткип 36°С), и надо быть всегда очень осторожным из-за его выдающейся пожароопасности. Ещё из неприятных свойств - у него очень характерный навязчивый запах, а в больших концентрациях пары эфира вызывают наркоз. Но при соблюдении предосторожности эфир очень удобен в работе, а иногда совершенно незаменим. При невозможности купить его - синтезируют из этанола.
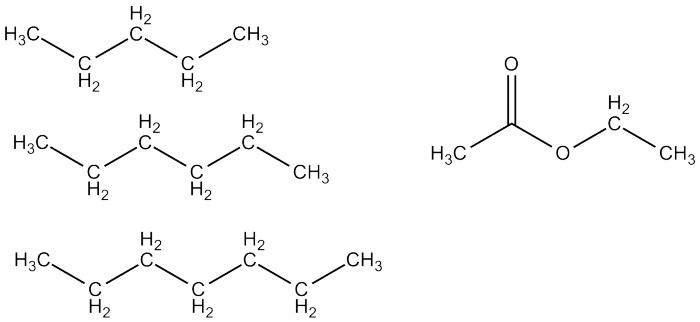
Говоря об экстракции, приходит на ум ещё один очень распространённый экстрагент - это петролейный эфир, представляющий собой лёгкие фракции бензина. При соответствующих возможностях используют чистый пентан, гексан или гептан. Вообще алканы обладают довольно слабой растворяющей способностью, и в большинстве случаев стоит использовать что-нибудь другое. Набор реакций, которые можно проводить в петролейном эфире, тоже очень ограничен. В основном петролейный эфир используют для очистки веществ - кристаллизации и хроматографии.
Хорошим экстрагентом является, например, этилацетат (этиловый эфир уксусной кислоты). Он относительно дёшев и нетоксичен, хотя и напоминает запахом лак для ногтей. Он растворяет довольно широкий спектр различной органики, но не очень стоек - в присутствии кислоты или щёлочи распадается, что, кстати, ограничивает возможности экстракции. Смеси этилацетата с петролейным эфиром в разных соотношениях используют для хроматографического разделения веществ, и на это занятие можно спокойно извести за день по нескольку литров каждого компонента.
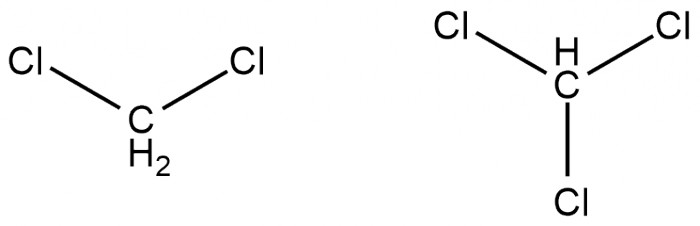
Продолжая тему несмешивающихся с водой растворителей, было бы неправильно обойти стороной хлорорганические растворители: дихлорметан и хлороформ. Они растворяют широкий спектр органики (вплоть до солей аминов), практически не растворяют в себе воду и очень легко испаряются (Ткип 40°С и 61°С соответственно). Важным отличием их является плотность: оба они почти в полтора раза плотнее воды, и поэтому при экстракции органический слой оказывается внизу, что иногда бывает удобно.
Дихлорметан считается относительно безопасным растворителем, а вот хлороформ может вызывать серьёзные отравления и повреждение печени, поэтому без вытяжки работать с ним не рекомендуется. Это, однако, не мешало ему когда-то использоваться как средство для ингаляционного наркоза. Также хлороформ при стоянии на воздухе и свету образует примесь фосгена, которая и является, скорее всего, основной причиной токсичности. Храните ваш хлороформ в тёмном и прохладном месте!
Для поиска свойств растворителей удобнее всего использовать Wikipedia, но можно использовать бумажные справочники (см. ниже), а также каталоги поставщиков хим. реактивов, например:
http://www.merckmillipore.com/RU/ru/product/Diethyl-ether,MDA_CHEM-100931?
https://www.alfa.com/ru/catalog/042254/
http://www.sigmaaldrich.com/catalog/product/sial/276855?lang=en®ion=RU
Справочники:
CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010.
Справочник по растворимости. - М.-Л.: ИАН СССР, 1962.
Справочник химика. - Л.-М.: Химия, 1964.
Журнал “Green Chemistry”: http://pubs.rsc.org/en/journals/journalissues/gc#!recentarticles&adv
Реакции в пиве и прочих напитках: https://www.chemistryworld.com/news/alcoholic-drinks-perfect-solvents-for-polymerisation-/6682.article