Осталась ещё одна группа соединений - те. которые имеют связь галоген-углерод. Некоторые из них довольно инертны и используются как растворители (хлороформ и дихлорметан), а некоторые - реакционноспособны, токсичны и даже опасны.
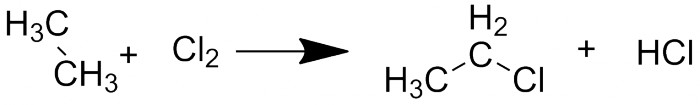
Я начну с монозамещённых соединений. Они получаются (в довольно жётских условиях) при реакции алканов с галогеном. При использовании фтора условия становятся жёсткими сами по себе: из-за зашкаливающей активности фтора реакция проходит со взрывом. Хлор - классический пример, но реакция редко бывает селективной - в той или иной степени будут образовываться продукты многократного замещения
Реакция алканов с галогенами на примере этана и хлора.
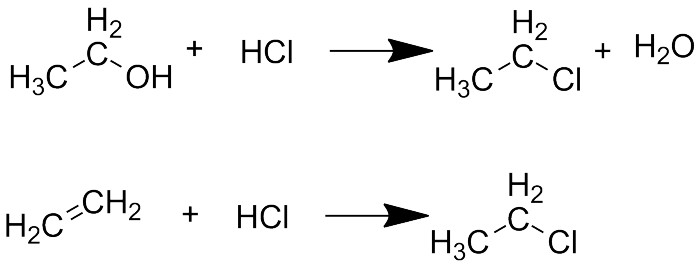
Другой, более щадящий способ - реакция спиртов с соответствующими кислотами (вернее, с самим хлороводородом или бромоводородом). Реакция обратима, но происходит с отщеплением воды, поэтому при использовании водоотнимающих реакгентов (например, серной кислоты) удаётся получить нужное соединение с хорошим выходом. Это тоже классическая реакция, которую пишет во всех учебниках и проводят во всех практикумах. Я уже писал о ней в статье про спирты.
Реакция этанола с хлороводородом и присоединение хлороводорода к этилену
Третий способ - присоединение к алкенам (гидрогалогенирование) - похож на предыдущий. При этом образуется галогеналкан, но присоединение может идти двумя путями с образованием разных соединений. При этом в обычных условиях галоген присоединяется к наиболее замещённому атому углерода, а водород идёт к менее замещённому (то есть тому, у кого больше водородов - как говорилось в школе: "деньги - к деньгам"). Это называется правилом Марковникова. Есть, однако, способы провести присоединение и строго против правила Марковникова.
Надо сказать, что и здесь, и в дальнейшем теория, рассказываемая в учебниках, заметно расходится с практикой, поэтому рекомендую за примерами обращаться к практикумам. Многие реакции (используемые в промышленности) проходят в жёстких условиях и требуют высокого давления, температуры и/или специальных катализаторов - всё это особая наука, на которую тратят свои усилия тысячи не самых глупых людей.
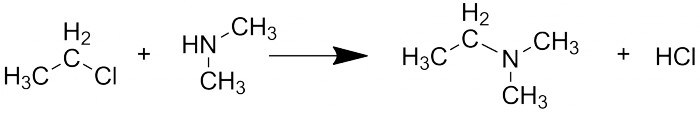
Монозамещённые галогеналканы (или алкилгалогениды, что то же самое) являются выраженными электрофилами: они присоединяются к нуклеофилам (аминам, спиртам, тиолам) с отщеплением галогенводорода. Это можно назвать основным их применением: с их помощью можно конструировать или модифицировать молекулы. Важно знать, что активность растёт в ряду I>Br>Cl>>F, то есть иодпроизводные активно вступают в реакции, а фторопроизводные практически нереакционноспособны.
Реакция с нуклеофилами на примере диметиламина.
Нуклеофилы существуют не только в колбах, но и в живых организмах, поэтому активные алкилгалогениды токсичны. Особенно этим славится метилиодид, который вдобавок ещё и крайне летуч.
При реакции метана с хлором получаются все четыре возможных соединения: метилхлорид, дихлорметан, хлороформ и тетрахлорметан (четырёххлористый углерод). В промышленности каждое из веществ затем выделяют перегонкой - чем больше галогенов в молекуле, тем выше температура кипения (а метилхлорид - газ при н.у.). Дихлорметан, хлороформ и ЧХУ используют в основном как растворители, реже - как реагенты. Гомолог дихлорметана - дихлорэтан - также является широко распространённым растворителем. Аналогичные производные более тяжёлых галогенидов (дибромметан, дииодметан, бромоформ и пр.) слишком реакционноспособны и используются гораздо реже.
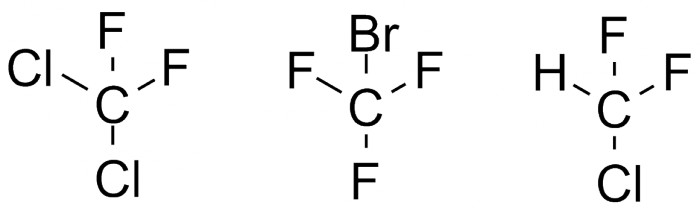
Галогеналканы легко испаряются и практически негорючи, поэтому их используют в качестве хладагента в холодильниках, ("фреон" - торговая марка для всего семейства хладагентов). Некоторые из таких соединений приведены на рисунке.
Фреоны
Известная проблема фреонов - их разрушающее действие на озоновый слой, но у новых фреонов оно гораздо слабее. Также все они в той или иной степени токсичны, но это не идёт ни в какое сравнение с применявшимся раньше в этих целях аммиаком.
Большинство галогеналканов не только негорючи, но и активно подавляют горение. В частности, в огнетушителях раньше можно было встретить бромэтан или четырёххлористый углерод. Сейчас на замену им пришли фторированные соединения, в частности Novec 1230 (называемый кое-где "сухой водой").
Хлороформ когда-то использовался как средство для наркоза, но сейчас он вытеснен более безопасными альтернативами - при длительном воздействии хлороформ токсичен для печени.
«Сухая вода»: https://en.wikipedia.org/wiki/Novec_1230, также по запросу Novec на youtube можно найти демонстрацию в действии.