Содержание статьи:
Углерод - химический элемент с атомным номером 6. Обозначается символом - C (лат. Carboneum).Аллотропные формы
Углерод может существовать по крайней мере в шести кристаллических формах, не считая недавно синтезированных фуллеренов. Это α- и β-графит, алмаз, лонедейлит (гексагональный алмаз), чаоит и углерод(VI). При нормальных температуре и давлении наиболее термодинамически устойчив α-графит (гексагональный). Модификации различаются либо по координационному окружению атомов углерода, либо по порядку расположения слоев в кристалле. Эти различия оказывают существенное влияние и на физические, и на химические свойства углерода.
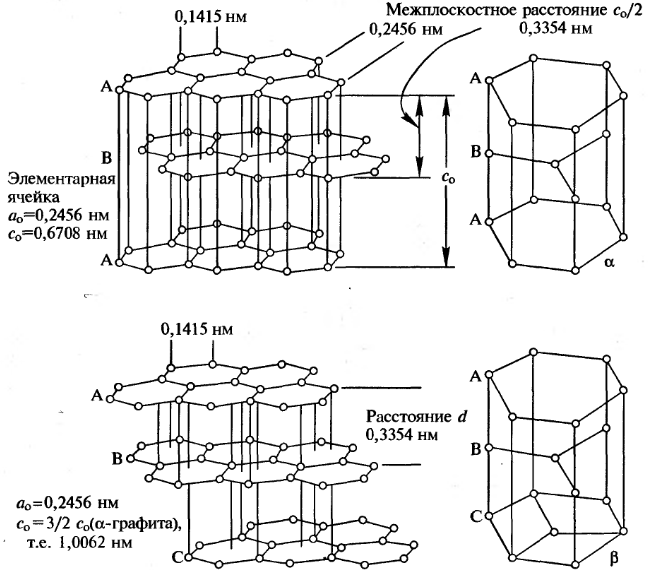
Атомы углерода в графите образуют плоские гексагональные слои:
Рис. 8.2. Структуры α-(гексагональной) и β-(ромбоэдрической) форм графита
В обычном α-графите слои чередуются в порядке •••ABAB•••, причем атомы углерода в слоях через один расположены друг над другом. В β-графите слои располагаются в порядке •••ABCABC•••. В обеих формах расстояние C-C внутри слоя равно 0,1415 нм, расстояние между слоями значительно больше - 0,3354 нм. Эти две формы переходят друг в друга при растирании (α→β) иди при нагревании выше 1025°С (β→α). Частичное превращение приводит к увеличению среднего расстояния между слоями; оно достигает максимума в 0,344 нм в турбостратическом графите, в котором чередование слоев носит случайный характер. Разница энтальпий образования α- и β-форм составляет всего 0,59±0,17 кДж•моль-1.
 Структура алмаза, демонстрирующая тетраэдрическую координацию атомов С; пунктирными линиями обозначена кубическая элементарная ячейка, содержащая 8 атомов углерода.
Структура алмаза, демонстрирующая тетраэдрическую координацию атомов С; пунктирными линиями обозначена кубическая элементарная ячейка, содержащая 8 атомов углерода.Следует обратить внимание, что хотя структура алмаза в целом не является плотнейшей упаковкой, она построена из двух взаимопроникающих гранецентрированных кубических решеток, сдвинутых вдоль объемной диагонали ячейки на четверть ее длины. Почти все встречающиеся в природе алмазы (~98%) имеют такую структуру, но содержат также небольшое количество атомов азота (0,05-0,25%), входящих в «пластиночки» приблизительною состава C3N (тип Iа) или, что крайне редко (~1%), рассеянных по объему кристалла (тип Iб). Совсем немного природных алмазов практически не содержит атомов N (тип IIа) и лишь малая часть таких камней (включая особо ценные голубые алмазы, тип IIб) содержит Al. Алмаз исключительно редкой гексагональной модификации - лонедейлит - был впервые обнаружен в метеоритном кратера Каньон Дьявола (Аризона) в 1967 г.: каждый атом С в нем имеет тетраэдрическую координацию, но тетраэдры образуют гексагональную решетку, подобную решетке вюрцита, а не кубическую решетку типа сфалерита, как в обычном алмазе. Лонедейлит можно получить из монокристалла α-графита при комнатной температуре статическим сжатием вдоль оси г, для стабилизации он должен быть, однако, нагрет до 1000°С под давлением (параметры решетки: a0 = 0,252 нм, c0 = 0,412 нм, dнабл = 3,3 г·см-3, dрасч = 3,51 г·см-3).
Две другие кристаллические формы углерода были открыты недавно. Чаоит, новая аллотропная модификация белого цвета, была впервые обнаружена в 1968 г. в графитовом гнейсе, сплавленном под ударом (Исполинский кратер, Бавария). Чаоит может быть получен искусственно в виде белых дендритов гексагональной симметрии путем возгонки пирографита в условиях свободного испарения при температуре выше ~2000°С и низком давлении (~10-4 мм рт. ст.). Кристаллы имеют 0,5 мкм в толщину и 5-10 мкм в длину; параметры ячейки до = 0,8945 нм, c0 = 1,4071 нм, dрасч = 3,43 г·см-3. Наконец, в 1972 г. вместе с чаоитом была получена новая аллотропная форма углерода - гексагональный углерод(VI). Он был получен при нагревании графита до ~2300 °С под действием электрического тока или облучения. Процесс осуществляли в атмосфере аргона при практически любом давлении в диапазоне от 10-4 мм рт. ст. до 1 атм; лазерное облучение было даже более эффективно (параметры кристаллов a0 = 0,533 нм, c0 =1,22 нм, d > 2,9 г·см-3). Структуры чаоита и углерода(VI) еще до конца не изучены; полагают, что они включают цепочки типа карбина -C=C-C=C-. Обе эти модификации значительно более устойчивы к окислению и восстановлению, чем графит, по свойствам они ближе к алмазу. В настоящее время существует предположение, что в диапазоне от условий существования стабильного графита до его температуры плавления существует последовательность по крайней мере из шести стабильных аллотропных форм карбина.
Источники: 3.
Физические свойства
| Модификация | алмаз | графит |
| Молярная масса, г/моль | 12,011 | |
| Температура плавления, °C | 4440 (12,4 ГПа) | 4489 (10,3 ГПа) |
| Температура кипения, °C | 3825 сублимация | |
| Плотность, г/см3 | 3,513 | 2,2 |
Химические свойства и методы получения
Аморфный углерод
Аморфный углерод, получаемый в промышленности и в лабораториях, обычно содержит соединения углерода (с атомами H, O, N, S), зольные компоненты и адсорбированные газы или пары. Углерод очень высокой чистоты необходим при работах с высоковакуумной аппаратурой.
Для обычиых целей достаточно чистоты углерода 99%. Этому требованию отвечают коксующиеся угли, сажа, активированный уголь и графит, очищенные с помощью следующих методов.
Очистка от зольных компонентов. Многократное кипячение с разб. HNO3; прокаливание в потоке хлора при 900-1000°С; обработка плавиковой кислотой для удаления силикатов; многочасовое прокаливание при 2000-3000 *С в вакууме, в атмосфере СО или инертных газов (при этом происходит, правда, изменение структуры - графитизация, т. е. переход к структуре графита).
Очистка от соединений углерода («коксование»). Соединения углерода не совсем полностью удается удалить при обработке растворителями. Для более полной очистки используют многочасовое прокаливание при 900-1000 °С в вакууме или атмосфере H2, N2 и инертных газов. Если содержание соединений углерода в препарате перед прокаливанием достигает нескольких процентов, то при прокаливании происходят изменения структуры, обусловленные образованием из этих углеродсодсржащих соединений атомов углерода. Подобные структурные изменения, как правило, ухудшают адсорбционные свойства препарата; устранить неблагоприятные последствия можно с помощью активирования, которое ие влияет на чистоту углерода.
Для разрушения кислородсодержащих соединений, адсорбированных на поверхности, препарат углерюда выдерживают при 1000°С; при этом кислород удаляется в виде CO или CO2.
Очистка от адсорбированных газов и паров. Необходимо иметь в виду, что активированный углерод при комнатной температуре может адсорбировать CO2, H2O и другие газы в количествах до нескольких процентов (по массе). Для очистки необходимо нагревание в течение нескольких часов при 300°С в высоком вакууме.
Источники: 2.
Препараты углерода для специальных целей
Сажа из монооксида углерода. Интерес, проявляемый к этому препарату, вызван тем, что сажа используется для выращивания кристаллов графита среднего размера, которые лишь незначительно слипаются в более крупные агрегаты. Для получения препарата над тонкодисперсным чистым железом (например, из карбонилов железа) пропускают CO при 400-700 °С. В зависимости от температуры получают кристаллы определенного размера: ~5 нм (400°С), ~10 нм (500°С), 20 нм (700°С). Следует иметь в виду, что соединения железа, загрязняющие препараты, удается удалить дополнительной очисткой.
Графитированная сажа. При многочасовом прокаливании сажи при 2000-3000°С в вакууме или в атмосфере инертного газа образуется графитированная сажа, в которой содержится определенное количество кристаллов графита, незначительно отличающихся по размеру от частиц исходной сажи (из газовой сажи вырастают кристаллы (термическая сажа) размером ~20 нм, из пламенной сажи ~50-200 нм, из термакса ~30 нм). Возникшие кристаллы графита имеют форму полиэдров, состоящих из нескольких сросшихся вершинами пирамид; грани полиэдра образованы базисными плоскостями (001) графита.
Сажа из оксида графита состоит из тончайших графитовых чешуек толщиной ~2-5 нм, диаметр которых может доходить до нескольких сотых долей миллиметра, что зависит от природы исходного графита. Для получения этой сажи графит оксидируют. Оксид графита разлагается при быстром нагревании до 300-400 °С. Поскольку при этом освобождается кислород, связанный в виде CO и CO2 в оксиде графита, не исключено, что в решетке графита возникают пустоты атомарных размеров.
Хороший продукт с подобными свойствами можно получить по следующей методике. Щелочную суспензию оксида графита восстанавливают гидроксиламином при 80°С. Чтобы предотвратить слипание чешуек сажи при фильтровании и высушивании, обессоленную путем диализа суспензию вымораживают.
Сажа, полученная по обеим методикам, содержит всего ~80% C (наряду с O, H и другими примесями). Для очистки продукт можно тотчас подвергнуть коксованию, а также освободить от зольных компонентов.
Блестящий углерод. Хрупкая фольга (пленка) с совершенной отражательной поверхностью; образуется в результате ориентации базисных плоскостей кристаллического графита параллельно плоскости фольги. Диаметр кусочков фольги может достигать нескольких сантиметров, а толщина - десятых долей миллиметра. Пленки из блестящего углерода, нанесенные на керамический материал, используются в качестве высокоомных сопротивлений. Размер кристаллов составляет ~2,5 нм.
Блестящий углерод получают путем разложения углеводородов (крекинга) при низком давлении (например, паров пропана при ~10 мм рт. ст.) или паров бензина, разбавленных азотом (через бензин при комнатной температуре пропускают N2). Разложение производят на гладких поверхностях (например, фарфор или кварц) при 800—1000°С. Целесообразно к углеводороду добавлять немного O2 или водяных паров для того, чтобы избежать потерь наиболее реакционноспособного углерода из-за осаждения на шероховатой поверхности. По достижении толщины нескольких сотых миллиметра пленки углерода отслаиваются сами (их легко также отделить после охлаждения). Покрытие лучшего качества получается на не совсем гладких поверхностях.
Источники: 2.
Получение пленки из графита
Способ 1. Золь, приготовленный путем встряхивания или перемешивания 1-2 г оксида графита в 100 г воды, концентрируют путем испарения. При этом на дне сосуда образуется пленка оксида графита. При очень медленном и осторожном нагревании происходит выделение CO, CO2 и H2O. При 1000°С образуется пленка графита, которая, однако, содержит несколько процентов кислорода и водорода. Размеры полученной пленки и ее толщина соответствуют размерам исходной пленки из оксида графита; их можно регулировать, изменяя количество и концентрацию взятого золя оксида графита, а также размеры сосуда, в котором производили концентрирование последнего. Можно получить пленку графита с поверхностью, например, 50 см2.
Способ 2. Очень чистую графитовую пленку можно получить при многочасовом отжиге фольги блестящего графита в вакууме или в атмосфере CO при 2000-3000 °С. Размеры полученной пленки такие же, как исходной из блестящего углерода, например 1 см в диаметре.
Источники: 2.
Активированный уголь. Получение
Повышение адсорбционной способности достигается разрыхлением кристаллической структуры углерода путем осторожного окисления. Углерод с высокой адсорбционной способностью при комнатной температуре, например, при контакте с полунасыщенным паром тетрахлорида углерода адсорбирует количество CCl4, равное собственной массе угля.
Разрыхление проще всего провести путем отжига в потоке CO2 или водяных паров при 950°С; отжиг продолжают до тех пор, пока углерод не выгорит наполовину. Для этого следует медленно пропускать CO2 над углеродом, распределенным тонким слоем в лодочке. Можно рекомендовать дополнительную очистку от адсорбированного CO2 или H2O путем многочасового нагревания при 300°С в высоком вакууме. При доступе воздуха на поверхности образуются оксиды, которые можно удалить при коксовании.
Источники: 2.
Список использованной литературы
- Волков, А.И., Жарский, И.М. Большой химический справочник / А.И. Волков, И.М. Жарский. - Мн.: Современная школа, 2005. - 608 с ISBN 985-6751-04-7. [c. 124]
- Гофман У., Рюдорф В., Хаас А., Шенк П. В., Губер Ф., Шмайсер М., Баудлер М., Бехер Х.-Й., Дёнгес Э., Шмидбаур Х., Эрлих П., Зайферт Х. И. Руководство по неорганическому синтезу: В 6-ти томах. Т.3. Пер. с. нем./Под ред. Г. Брауэра. - М.: Мир, 1985. - 392 с., ил. [с. 669-671]
- Гинвуд Н. Химия элементов: в 2 т. Т.1 / Н. Гринвуд, А. Эрншо ; пер. с англ. - 3-е изд. - М. : БИНОМ. Лаборатория знаний, 2015. - 607 с. : ил. ISBN 978-5-9963-1733-2 (Т. 1), ISBN 978-5-9963-1732-5 [c. 260-261]