Содержание статьи:
Водород - первый элемент периодической системы элементов; обозначается символом H. Простое вещество водород H2 (легкий водород, дипротий) - легкий бесцветный газ без запаха и вкуса; обладает, в особенности при повышенных температурах, сильным восстановительным действием.Природный водород содержит изотоп 1H (протий) с примесью стабильного изотопа 2H (дейтерий D, преобладает) и радиоактивного изотопа 3H (тритий T, следы).
Физические свойства
| Молярная масса | H2 2,016 г/моль |
| Температура плавления, tпл. | -259,34 °C |
| Температура кипения, tкип. | -252,87 °C |
| Плотность, ρ | 0,082 г/дм3 |
Неметалл. Бесцветный трудносжижаемый газ. Очень мало растворяется в воде, лучше - в органических растворителях. Хемосорбируется металлами (Fe, Ni, Pt, Pd).
Методы получения
Выпускающийся в стальных баллонах водород получают электролизом или из водяного газа.
Электролитический водород представляет собой газ 99,7-99,8%-ной чистоты, который в виде примеси содержит только воздух - и, в частности, кислород - в количестве, меньшем 0,1%. Этот газ пропускают при 400°С через трубку, наполненную восстановленным оксидом меди (в виде проволоки), или, по методу Мейера и Ронге, через башню с «активной медью», или при 30—50°С через колонку с восстановленным катализатором BTS фирмы BASF. Далее водород высушивают хлоридом кальция и пентаоксидом фосфора. Такой водород можно применять для большинства лабораторных целей, так как присутствие незначительного количества азота (около 0,2%) редко служит помехой.
Водород, полученный из водяного газа, содержит заметные количества примесей оксида углерода, диоксида углерода, кислорода и азота, а иногда также AsH3 и Fe(CO)5. Для поглощения диоксида углерода применяют гидроксид калия или натронную известь; AsH3 поглощают насыщенным раствором перманганата калия в присутствии избытка твердого KMnO4. Для удаления кислорода газ пропускают, как это описано выше, над нагретой медью или раскаленным докрасна платинированным асбестом, причем одновременно происходит термическое разложение Fe(CO)5. Оксид углерода удаляется при пропускании газа через восстановленный BTS-катализатор, а также путем вымораживания жидким азотом. Вообще для получения очень чистого водорода следует по возможности исходить из электролитического водорода.
Дальнейшую очистку водорода проводят, адсорбируя примеси на активном угле, силикагеле или молекулярных ситах. Для получения наиболее чистого, совершенно не содержащего воздуха, водорода используют следующие методы:
- Способ 1. Нагревание палладия, насыщенного водородом (см. ниже);
- Способ 2. Диффузия через палладий или сплав палладия с серебром (см. ниже);
- Способ 3. Диффузия через никель (см. ниже);
- Способ 4. Разложение гидрида урана(III);
- Способ 5. Разложение гидрида титана;
- Способ 6. Электролиз без доступа воздуха.
Нагревание палладия, насыщенного водородом
Губку палладия, полученную путем восстановления дихлорида палладия в растворе, тщательно промывают горячей водой и после высушивания сильно прокаливают в пламени паяльной горелки. Еще в горячем состоянии губку помещают в нагретую трубку с присоединенным к ней манометром и медленно охлаждают в вакууме. Затем при комнатной температуре через трубку пропускают поток тщательно очищенного и высушенного водорода. Поглощение палладием водорода сопровождается слабым раскаливанием. Путем последующего нагревания до 200°C поглощенный водород можно снова выделить, причем при слабом отсасывании ею насосом получается равномерный поток очень чистого газа. Количество выделившегося водорода составляет при нормальных условиях около 100 мл/г палладия.
Диффузия через палладий или сплав палладия с серебром
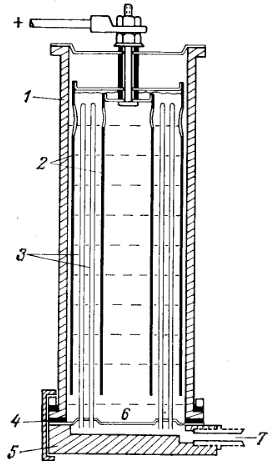
Рис. Разрез электролизера для получения водорода высокой чистоты путем электролиза поды с последующей диффузией через сплав палладий-серебро.
1 - стеклянный цилиндр (диаметр 10 см);
2 - концентрические платиновые аноды;
3 - диффузионные трубки из сплава палладий-серебро (100 штук), нижние концы которых закреплены путем припайки золотом к платиновой пластине 4;
5 - тефлоновое уплотнение;
6 - основание в виде стальной плиты;
7 - трубка для отвода водорода высокой чистоты.
Метод диффузии при повышенной температуре через металлический палладий или его сплавы с серебром в основном используется в технике для непрерывного получения больших количеств очень чистого водорода. Получение водорода в лабораторных условиях удобно осуществлять в приборе для электролиза и диффузии, устройство которого показано на рис. Прибор заполняется разбавленной серной кислотой и работает при температуре 70°С и плотности тока 2 А/см2. Между двумя анодами из платины находятся 100 трубок из сплава палладия с серебром (25% Ag), служащие катодами. Наружный диаметр трубок равен 1,6 мм при толщине стенок 7,6·10-2 мм. Прибор работает на постоянном токе (выпрямитель) и дает 2 л водорода в минуту при содержании примесей менее 1 млн-1. Прибор прост в эксплуатации, поскольку не требует дополнительного подогрева, и для его заправки необходима только дистиллированная вода.
Диффузия через никель
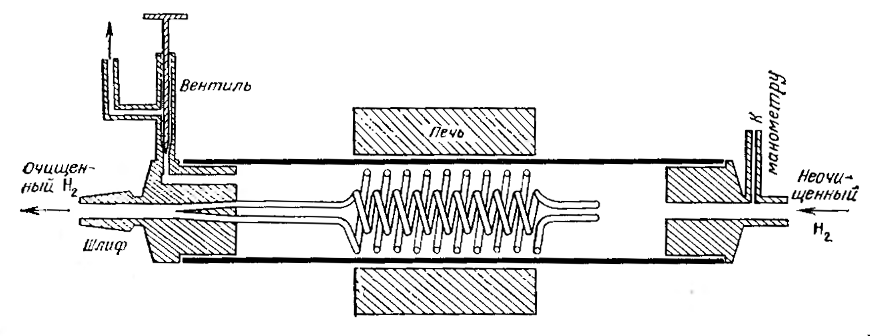
Очистку поступающего в продажу водорода проводят в приборе, схема/ которого показана на рис. 98. Прибор позволяет получить поток очень чистого водорода при атмосферном давлении. Пять цельнотянутых никелевых трубок диаметром 2 мм, с толщиной стенок 0,1 мм и длиной 5 м, изогнутых в виде спиралей, одним концом впаиваются в латунную головку, оканчивающуюся нормальным шлифом. Для того чтобы трубки было легче вставлять в головку, их в течение 2 ч нагревают до 1000°С в атмосфере водорода, после чего их можно легко гнуть руками. Другие концы трубок запаивают наглухо. Никелевые спирали помещают в кварцевую трубку диаметром 35 мм и длиной 1 м. Латунные головки приклеивают на пиценне.
Рис. Конструкция прибора для очистки водорода путем его диффузии через никель.
В головке с нормальным шлифом имеется игольчатый вентиль, служащий для тонкой регулировки избыточного давления и выжигания примесей, накапливающихся в кварцевой трубке. В головке на другом конце кварцевой трубки подсоединен ртутный манометр. Нагревание кварцевой трубки производят только в ее центре так, чтобы места припаивания никелевых трубок не нагревались. В зависимости от режима работы прибора его производительность (мл/мин) изменяется следующим образом:
| Температура, °C | Избыточное давление, мм рт. ст. | |||
| 15 | 20 | 25 | 30 | |
| 750 | 20 | 27 | 34 | 41 |
| 815 | 27 | 36 | 43 | 52 |
| 860 | 34 | 45 | 55 | 68 |
| 900 | 41 | 54 | 68 | 84 |
Скорость подачи газа пропорциональна величине избыточного давления, тогда как зависимость от температуры не является линейной. Путем изменения давления скорость подачи может быть практически моментально отрегулирована до нужного уровня. При наличии хорошего вентиля на баллоне с водородом аппаратура работает без сбоев. Продолжительность непрерывной работы составляет не менее 250 ч. Перед каждым новым опытом следует убедиться в герметичности аппаратуры.
Химические свойства
Сильный восстановитель. При повышенных температурах, реагирует с металлами, неметаллами, оксидами металлов. Особенно высока восстановительная способность у атомного водорода H0. образующегося при термическом разложении молекулярного водорода H2 или в результате реакций непосредственно в зоне проведения восстановительного процесса.
Список использованной литературы
- Волков, А.И., Жарский, И.М. Большой химический справочник / А.И. Волков, И.М. Жарский. - Мн.: Современная школа, 2005. - 608 с ISBN 985-6751-04-7. [c. 151]
- M. Баудлер, Г. Брауэр, Ф. Губер, В. Квасник, П.В. Шенк, М. Шмайсер, Р. Штойдель. Руководство по неорганическому синтезу: В 6-ти томах. Т.1. Пер. с. нем./Под ред. Г. Брауэра. - М.: Мир, 1985. - 320 с., ил. [с. 147-152]
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. 3-е изд. испр./Р.А. Лидин, В.А. Молочко, Л.Л Андреева; Под ред. Р.А. Лидина. - М.: Химия, 2000. 480 с. ил. ISBN 5-7245-1163-0