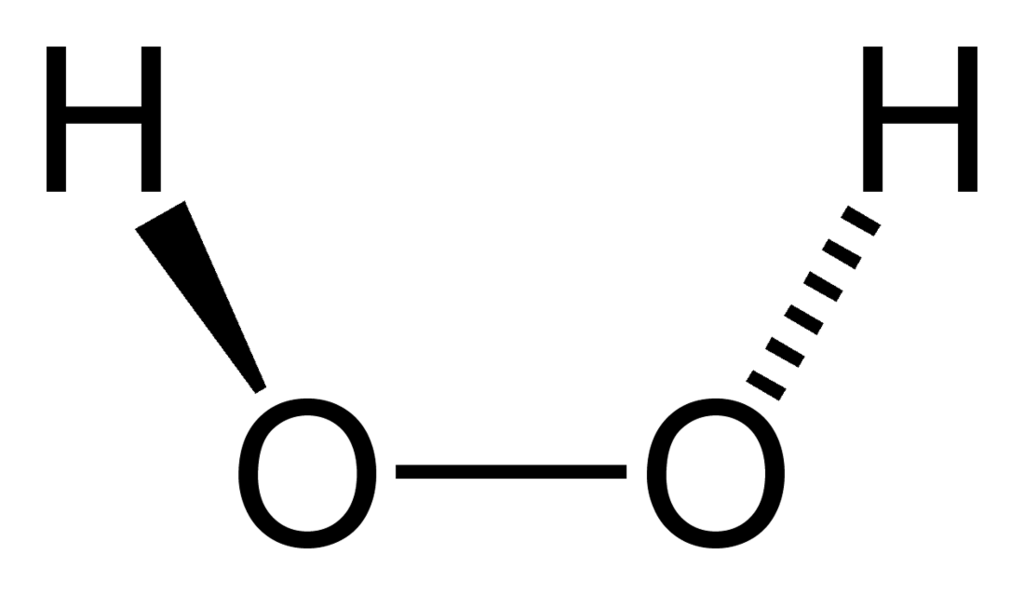
Другие названия: перекись водорода.
Пероксид водорода - неорганическое соединение с химической формулой H2O2.
Физические свойства
| Молярная масса | 34,015 г/моль |
| Температура плавления, tпл. | -0,43 °C |
| Температура кипения, tкип. | 150,2 °C |
| Плотность, ρ | 1,44 г/см3 |
Химические свойства и методы получения
Правила техники безопасности
При всех работах с концентрированным пероксидом водорода, особенно» в присутствии органических веществ или катализаторов разложения, следует на случай возможного разложения со взрывом принимать соответствующие меры предосторожности. К ним относится использование защитных очков и масок, ограждение аппаратуры защитными экранами из органического или безосколочного стекла.
Стеклянные приборы, в которых получают пероксид водорода или работают с ним, должны быть изготовлены из стекла пиреке или иенского стекла. Приборы перед употреблением обрабатывают концентрированной серной кислотой или олеумом (но не хромовой смесью!), основательно промывают дистиллированной водой и затем высушивают, не допуская попадания пыли.
Удаление воды из пероксида водорода
Способ 1. По методу, впервые описанному Штеделем и позднее неоднократно применявшемуся другими авторами, значительную часть, воды из 30%-ного H2O2 удаляют перегонкой; полученный H2O2 кристаллизуют при охлаждении и кристаллы отделяют от маточного раствора.
Керн нормального шлифа дистилляционной колбы вместимостью 500 мл закрывают муфтой с кипятильным капилляром. Колбу соединяют на шлифах со змеевиковым холодильником и далее с приемником вместимостью 200 мл. В колбу наливают 180 мл продажного 30%-ного пероксида водорода (ч. д. а.) и помещают на водяную баню с температурой 45-50 °С. Перегонку проводят при давлении 16-22 мм рт. ст. в течение ~3,5 ч. При этом отгоняется 150-160 мл воды и немного H2O2, а остаток представляет собой 95-98%-ный пероксид водорода. На колбе приемника предварительно наносят метку в соответствии с объемом воды, который необходимо отогнать. Если температура водяной бани поднимается выше 52°С, высококонцентрированный H2O2 приобретает желтую окраску и становится непригодным для дальнейшей работы. Концентрированный пероксид водорода можно вылить из колбы, не опасаясь разложения. (Если вместо керна горло колбы имело бы шлифованную муфту, то при соприкосновении с шероховатой поверхностью могло бы произойти разложение значительной части H2O2.)
Полученные кристаллы при комнатной температуре очень легко разлагается с выделением кислорода. Поэтому их необходимо сохранять на холоду в закрытых полиэтиленовых или стеклянных парафинированных сосудах. Непродолжительное хранение можно осуществлять и в непарафииироваиных стеклянных сосудах. Полученные при центрифугировании водные растворы лероксида водорода можно снова сконцентрировать путем перегонки.
При проведении однократной кристаллизации 98%-ного раствора в пробирке с последующим сливанием маточного раствора можно получить не более чем 99%-ный H2O2.
Способ 2. 80-90%-ный продукт получают, смешав 30%-ный H2O2 с двойным количеством пара-цимола а и отогнав из этой смеси в вакууме водоструйного насоса при температуре ~50°С большую часть воды и пара-цимола. Остаток, представляющий собой двухфазную смесь лдра-цимола и шерокснда водорода, разделяют механически. Дальнейшую переработку ведут, как это было описано выше.
Способ 3. Небольшие количества H2O2 можно получить простым способом путем экстракции эфиром. Для этого смешивают 10 мл 90-98%-ного пероксида водорода и 100 мл диэтилового эфира. Из образовавшейся двухфазной смеси отделяют эфирный слой, который затем высушивают взбалтыванием с CaCl2 и два или три раза с P4O10. Если для реакции нельзя непосредственно использовать полученный эфирный раствор, то безводный пероксид водорода получают (после удаления эфира в вакууме водоструйного насоса) путем фракционной перегонки в высоком вакууме. Однако, согласно полученный таким путем H2O2 может быть загрязнен продуктами окисления эфира.
Другие способы получения. Описан метод получения 99-99,7%-ного пероксида водорода путем многократной фракционной перегонки 60-90%-ною раствора, производимой в колонне в высоком вакууме.
Получение H2O2 спектральной чистоты можно осуществить по способу, предложенному для синтеза D2O2. Этот способ, опирающийся основан на взаимодействии персульфата с водяным паром.
Список использованной литературы
- Волков, А.И., Жарский, И.М. Большой химический справочник / А.И. Волков, И.М. Жарский. - Мн.: Современная школа, 2005. - 608 с ISBN 985-6751-04-7. [c. 151]
- M. Баудлер, Г. Брауэр, Ф. Губер, В. Квасник, П.В. Шенк, М. Шмайсер, Р. Штойдель. Руководство по неорганическому синтезу: В 6-ти томах. Т.1. Пер. с. нем./Под ред. Г. Брауэра. - М.: Мир, 1985. - 320 с., ил. [с. 177-179]