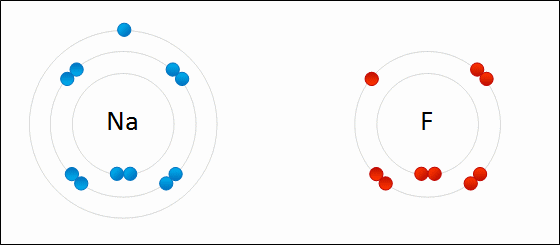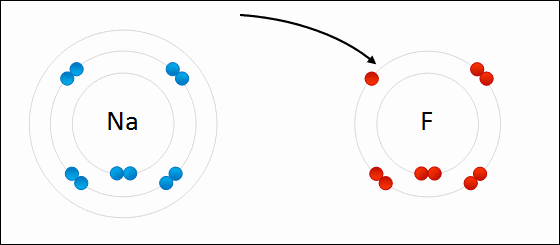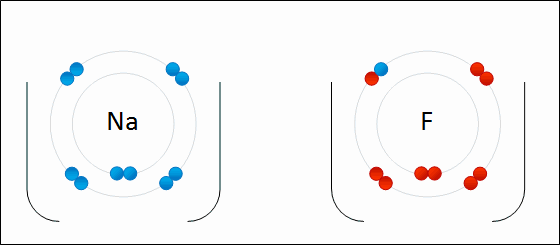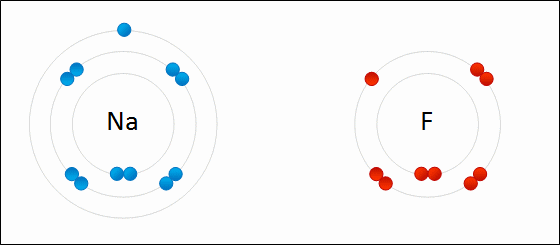
связь будет преимущественно ионной, если заряды образующихся ионов невелики, радиус катиона велик, а радиус аниона мал.
Рис. Представление ионной связи между натрием и фтором с образованием фтористого натрия.
К ионным соединениям относят большинство соединений типичных металлов с кислородом, галогенами и серой. Ионная связь возникает также между катионами металлов, а также ионом аммония NH4+ и такими анионами, как перхлорат ClO4-, карбонат CO32-, нитрат NO3- и др. Ион, находящийся в узле кристаллической решетки, имеет близкое к сферическому электрическое поле, позволяющее ему взаимодействовать с противоположно заряженными ионами в любых направлениях, причем число таких ионов определяется в первую очередь размерами и зарядами ионов. На основании этого считают, что:
Соединения с ионным типом связи образуются в результате взаимодействия элементов, атомы которых значительно различаются электронегативностью.ионная связь не имеет направленности и насыщаемости.
Образования ионной связи
Ионная связь возникает при условии, что разница между значениями электроотрицательностей элементов превышает 1,9. Если же эта разница меньше за 1,9, то ковалентная связь имеет характер. Например, натрий бурно реагирует с хлором, в результате чего образуется хлорид натрия имеет ионную кристаллическую структуру (χCl - χNa = 3,0 - 0,9 = 2,1 > 1,9):
- 2Na(тв.) + Cl2(г.) → 2NaCl(тв.)
- при взаимодействии двух атомов один из них отдает электрон и превращается в положительно заряженный ион (M - 1e- → M+) — катион, другой атом присоединяет электрон и превращается в отрицательно заряженный ион (A + 1e- → A-) — анион;
- ионы с противоположными зарядами электростатически притягиваются друг к другу и образуют устойчивое соединение с йонним связью.
Хлорид натрия NaCl является типичным примером ионной соединения. Такие процессы превращения атомов в ионы оказываются энергетически выгодными тогда, когда атом, отдающий электрон, имеет низкую энергию ионизации, а атом, что его присоединяет, — большое сродство к электрону.
В реакциях, в результате которых образуются соединения с ионным типом связи, атомы пытаются приобрести самой стойкой электронной конфигурации. Так, одноатомные анионы F-, Cl-, Br- и некоторые катионы (Ka+, A+, Ca2+, Ba2+) имеют строение внешнего электронного слоя атомов ближайшего инертного газа (ns2np6).
В более сложных случаях образования катионов связывают с относительным повышением устойчивости их полностью сформированных энергетических подуровней:
Итак, простые катионы легче всего образуют щелочные и щелочноземельные металлы. Они имеют большие атомные радиусы и низкие значения энергий ионизации I, лежащие в пределах 375-520 кДж/моль. На простые одноатомные анионы превращаются атомы p-элементов VII группы, которые имеют наибольшее сродство к электрону Eсп = 320...350 кДж/моль. Вместе с тем ранее отмечалось, что образование двух - и многозарядных одноатомных анионов типа O2-, S2-N3- с соответствующих однозарядных ионов оказывается энергетически невыгодным процессом вследствие возникновения значительных сил электростатического отталкивания.В реакциях, в результате которых образуются соединения с ионным типом связи, атомы пытаются приобрести самой стойкой электронной конфигурации. Так, одноатомные анионы F-, Cl-, Br- и некоторые катионы (Ka+, A+, Ca2+, Ba2+) имеют строение внешнего электронного слоя атомов ближайшего инертного газа (ns2np6).
В более сложных случаях образования катионов связывают с относительным повышением устойчивости их полностью сформированных энергетических подуровней:
- Ag (4d105s1) → Ag+ (4d10);
- Zn (3d104s2) → Zn2+ (3d10);
- Ga (3d104s24p1) → Ga3+ (3d10);
- Bi (6s26p3) → Bi3+ (6s2).
Согласно квантово-механическим расчетам присоединения второго и последующих электронов к атомам неметаллов оказывается невозможным, поэтому одноатомные многозарядные анионы не могут уособлено выделяться даже в кристаллических оксидах типа Na2O CaO. Наоборот, существование многоатомных анионов типа SO42-, CO32-, PO43- и других энергетически возможно, поскольку в этом случае происходит распределение избытка электронов между несколькими атомами, что приводит к уменьшению на отдельных атомах значение отрицательного заряда.
Свойства ионной связи
В основу ионной связи возложена преимущественно электростатическое взаимодействие между ионами, поэтому, в отличие от ковалентной, ионная связь характеризуется ненапрямленістю и ненасыщенностью.
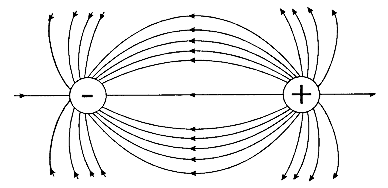
Ненапрямленость ионной связи обусловлена тем, что электрическое поле каждого иона, который мысленно можно рассматривать как заряженную сферу, распространяется в пространстве во всех направлениях.
Ненасыщенность ионной связи связана с тем, что в результате взаимодействия двух противоположно заряженных ионов их электрические поля компенсируются не полностью, поэтому возможно притяжение этих ионов в других направлениях. В результате каждый ион окружает себя ионами противоположного заряда.
Распределение электрических силовых полей двух противоположно заряженных ионов
Соединения с ионным типом связи в виде молекул не существуют ни в твердом состоянии, в котором они имеют ионную кристаллическую решетку, ни в растворе, где они диссоциируют на ионы под влиянием полярных молекул растворителя. Неустойчивые молекулы ионных соединений (NaCl, LiCl и др.), а также их ассоциаты можно обнаружить только в газовом состоянии при высоких температурах.
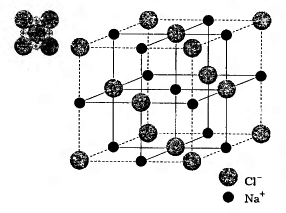
В отличие от ковалентных соединений число координированных (которые формируют ближайшее окружение) вокруг каждого иона частиц противоположного заряда в ионных кристаллах (координационное число — кол. ч.) определяется прежде всего спецификой электронного строения атома элемента, а соотношением размеров ионов, что стараются окружить себя максимально возможным числом противоположно заряженных частиц. За соотношение радиусов ионов 0,41-0,73 имеет место октаедрична взаимная координация ионов (к. ч. = 6); при соотношении 0,73-1,37 — кубическая (к. ч. = 8). Например, в кристаллической решетке NaCl каждый ион натрия окружен шестью ионами хлора, которые имеют противоположный заряд (ri(Na+)/ri(Cl-)) = 98 пм/181 пм = 0,53).
Кристаллическая решетка хлорида натрия
Список использованной литературы
- Попков В. А., Пузаков С. А. Общая химия: учебник. - М.: ГЭОТАР-Медия, 2010. - 976 с.: ISBN 978-5-9704-1570-2. [с. 37]