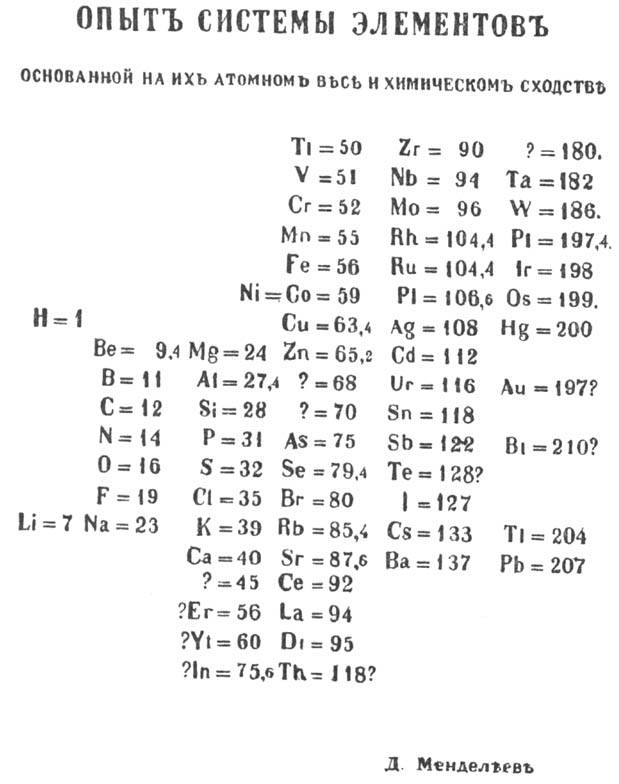Періодичний закон - фундаментальний закон природи, відкритий Д. І. Менделєєвим в 1869 році при зіставленні властивостей відомих в той час хімічних елементів і величин їх атомних мас. В даний час Періодичний закон має наступне формулювання:
- «властивості хімічних елементів, а також форми і властивості утворених ними простих речовин і сполук перебувають у періодичній залежності від величини зарядів ядер їх атомів».
Історія
У 1869 р. видатний російський учений Д. І. Менделеев, ґрунтуючись на глибокому вивченні та систематизації властивостей відомих на той час 64 хімічних елементів, установив, що всі елементи природи не є незалежною один від одного сукупністю, а між ними існують глибокі взаємозв’язки.
Д. І. Менделєєв розмістив хімічні елементи в порядку зростання їхніх атомних мас і виявив періодичність повторення їхніх властивостей. На основі цього він сформулював закон періодичності:
- властивості простих тіл, а також форми і властивості сполук елементів перебувають у періодичній залежності від величини атомних ваг елементів.
Д. І. Менделєєв зумів розпізнати у відкритому ним законі фундаментальний закон природи і відразу ж застосував його для передбачення властивостей ще не відкритих елементів та для виправлення неправильних атомних мас деяких елементів.
Глибину хімічних знань Д. І. Менделєєва та точність його передбачень ілюструє зіставляння властивостей екасиліцію (тобто елемента, розміщеного в групі після силіцію), та елемента, який згодом був відкритті і названий германієм:
| Показник | Екасиліцій | Германій |
| Відносна атомна маса | 72 | 72,33 |
| Атомний обєм, см3/моль | 13 | 13,22 |
| Густина, г/см3 | 5,5 | 5,47 |
| Питома теплоємність, Дж/моль | 0,305 | 0,318 |
| Колір | Темно-сірий | Сірувато-білий |
| Густина діоксиду EO2, г/см3 | 4,7 | 4,703 |
| Температура кипіння тетрахлориду TCl4, °C | 100 | 86 |
| Густина тетрахлориду TCl4, г/см3 | 1,9 | 1,887 |
| Температура кипіння тетраетилпохідного, °C | 160 | 160 |
Запропонована Д. І. Менделєєвим періодична система в процесі відкриття нових елементів змінювалась, у ній з’явилась група інертних газів, але суть її побудови залишилась незмінною.
Д. І. Менделєєв, як і інші вчені того часу, не зміг пояснити справжньої причини установленої періодичності повторення властивостей елементів та форм і властивостей їхніх сполук Крім того, у процесі побудови таблиці вчений сам порушив принцип розміщення елементів за зростанням їхніх атомних мас. Наприклад, під час розміщення кобальту і нікелю, телуру і йоду він віддав перевагу характеру зміни хімічних властивостей.
Поступово ставало зрозумілим, що причину періодичності треба шукати в глибинах будови атомів.
Список використаної літератури
- Загальна та неорганічна хімія: Підручник для студ. вищ. навч. закл. / О.М. Степаненко, Л. Г. Рейтер, В. М. Ледовських, С.В. Іванов. - К.: Пед. преса, 2000. - 784 с.: іл. ISBN 966-7320-13-8