Загальна формула алкінів з одним потрійним зв'язком: CnH2n-2
Зміст статті:
Номенклатура IUPACЗа номенклатурою IUPAC алкіни називають, замінюючи в алканах закінчення -ан на -ин (-ін). Головний вуглецевий ланцюг повинен включати потрійний зв'язок, навіть якщо він не найдовший. Нумерацію ланцюга починають з того кінця, ближче до якого знаходиться потрійний C≡C-зв'язок.
Приклад:
- HC≡CH етин (ацетилен)
- HC≡C-CH3 пропін
- HC≡C-CH2-CH2-СH3 1-пентин
- H3C-C≡C-CH2-СH3 2-пентин
1. Карбідний метод. Метод започаткований Ф. Велером 1862 р. Метод потребує значних енергетичних затрат і не є економічно вигідним. Метод базується на випалі вапняку та його подальшому спіканні з вугіллям (коксом) при 2000°C. В результаті реакції утворюється карбід кальцію CaC2, який гідролізують до ацетилену:
CaCO3 → CaO + CO2
CaO + 3C → CaC2 + CO
CaC2 + 2H2O → Ca(OH)2 + HC≡CH
З карбіду магнію аналогічно утворюються пропін і частково ацетилен:
Mg2C3 + 4H2O → CH3-C≡CH + 2Mg(OH)2
2. Піроліз алканів. Метан піддають дії високої температури (близько 1500°C) за кородкий проміжок часу (приблизно одна секунда контакту) і потім швидко охолоджують з метою уникнути подальшого розщеплення ацетилену на вуглець та водень.
2CH4 → HC≡CH + 3H2
Перспективним методом є окиснювальний піроліз або електрокрекінг метану (температура близько 1500°C) з виходом ацетилену до 15%:
4CH4 + O2 → HC≡CH + 2CO + 7H2
Велике значення має піроліз вуглеводневої сировини (бензин, гас) при 1200-1500°C, який проходить легше, ніж піроліз метану:
C6H14 → 3HC≡CH + 4H2
Ацетилен доцільно добувати як побічний продукт піролізу нафтових фракцій у процесі одержання етилену (до 20 кг ацетилену).
Лабораторні методи добування
1. Відщеплення галогеноводню від дигалогеналканів або галогеналкенів (дегідрогалогенування). При підвищених температурах у присутності спиртових розчинів концентрованого лугу або інших сильних основ (алкоголятів, амідів натрію) утворюються алкіни:
CH2Br-CH2Br 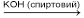 CH2=CHBr + HBr
CH2=CHBr + HBr
CH2=CHBr HC≡CH + HBr
HC≡CH + HBr
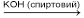 CH2=CHBr + HBr
CH2=CHBr + HBr CH2=CHBr
 HC≡CH + HBr
HC≡CH + HBr 2. Реакції алкілування. Атоми водню в ацетилені заміщуються атомами металів з утворенням ацетиленідів, які при дії алкілгалогенідів перетворюються у відповідні алкіни:
HC≡CH + NaNH2 → HC≡C-Na + NH3
HC≡C-Na + CH3Br → HC≡C-CH3 + NaBr
Фізичні властивості
Алкіни C2-C4 - це гази, C3-C16 - рідини, від C17 - тверді речовини. Значення густини та показника заломлення для алканів значно вищі, ніж для алкенів і алканів.
Список використаної літератури
- Ю.О.Ластухін, С.А.Воронов. Органічна хімія. Підручник для вищих навчальних закладів. - Львів: Центр Європи, 2006. - 864 с. ISBN 966-7022-19-6
