При користуванні ступенями окиснення корисно дотримуватись наступних правил:
- Алгебраїчна сума ступенів окиснення усіх атомів у сполуці завжди рівна нулю, а для складного іону - його заряду.
- Сума ступенів окиснення атомів у будь-якій частинці рівна її електричному заряду. Виходячи з цього, ступінь окиснення елемента у простій речовині рівна нулю.
- У сполуці з іншими елементами фтор завжди проявляє ступінь окиснення -1.
- Ступінь окиснення кисню у сполуках зазвичай рівний -2, за винятком пероксидних, надпероксидних сполук, озонідів та фториду кисню, де ступені відповідно рівні -1, -1/2, -1/3, +2 (Na2O2, KO2, KO3, OF2).
- Ступінь окиснення водню частіше +1 та рідше -1 для гідридів металів (NaH, CaH2).
- Лужні метали у всіх сполуках мають ступінь окиснення +1, лужноземельні +2.
- Максимальна додатна ступінь окиснення елементу часто чисельно збігається з номером його групи у періодичній системі. Максимальна від'ємна ступінь окиснення елемента рівна максимальній додатній ступені міну вісім. Виключенням є фтор, кисень, гелій, неон, аргон, а також елементи підгрупи кобальту та нікелю: їх найвища ступінь окиснення виражається числом, значення якого менше ніж номер групи, до якої вони відносяться. У елементів підгрупи міді, навпаки, найвища ступінь окиснення більша одиниці, хоча вони і відносяться до I групи.
Для відображення у назвах бінарних сполук від'ємної ступені окиснення елементів до їх латинських назв додають суфікс -ід(-ид), наприклад:
- NaCl - хлорид натрію,
- H2S - сульфід водню,
- NF3 - фторид азоту.
Додатна ступінь окиснення елемента вказується у дужках римською цифрою:
- FeCl3 - хлорид заліза(III),
- FeCl2 - хлорид заліза(II).
Приклад
Обчислення ступеня окиснення сірки у сульфатній кислоті H2SO4. Використовуючи правила отримуємо:
- ступінь окиснення кисню -2,
- ступінь окиснення водню +1,
- алгебраїчна сума ступенів окиснення атомів у сполуці рівна нулю.
ступень окиснення сірки приймаємо за x:
- (+1)·2 + х + (-2)·4 = 0
- x = +6
Розставимо ступені: 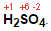
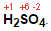
Список використаної літератури
- Загальна та неорганічна хімія: Підручник для студ. вищ. навч. закл. / О.М. Степаненко, Л. Г. Рейтер, В. М. Ледовських, С.В. Іванов. - К.: Пед. преса, 2000. - 784 с.: іл. ISBN 966-7320-13-8 [c. 193-194]
- Ахметов Н.С. Общая и неорганическая химия. Учеб. для вузов. - 4-е изд., испр. - М.: Высш. шк., Изд. центр "Академия", 2001. - 743 с., ил.[c. 95-96]
