Відомі оксиди всіх хімічних елементів за винятком He, Ne, Ar та F. Якщо елемент утворює кілька оксидів, то в їхніх назвах зазначають ступінь окиснення цього елемента, наприклад: FeO — оксид заліза(ІІ), Fe2O3 —оксид заліза(ІІІ). В оксидах відсутній безпосередній зв'язок атомів кисню між собою і кожний з них має ступінь окиснення тільки -2. Є також бінарні кисневмісні сполуки (Na2O2, BaO2 тощо), які не належать до оксидів. У молекулах таких сполук атоми кисню сполучаються між собою з утворенням пероксидного угруповання -O-O-, в якому кисень має ступінь окиснення -1. Такі сполуки називають пероксидами. Пероксиди належать до солей слабкої кислоти — пероксиду водню.
Для зображення будови оксидів використовують графічні, або структурні, формули, наприклад:
Оксид вуглецю(IV) CO2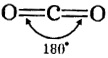 sp-Гібридизація | Оксид сірки(IV) SO2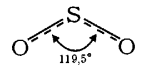 sp2-Гібридизація | Оксид хлору (I) Cl2O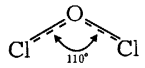 sp3-Гібридизація |
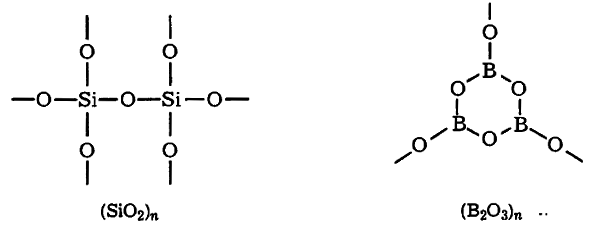
Багато оксидів за звичайних умов є полімерними сполуками:
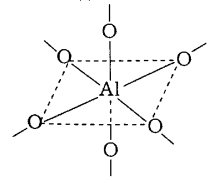
або утворюють координаційні кристалічні ґратки. Так, полімерний оксид алюмінію складається з октаедричних фрагментів.
Відомо, що кисень безпосередньо окиснює більшість елементів за винятком благородних газів, благородних металів (Au, Pt) та галогенів, тому оксиди можна одержати взаємодією простих речовин з киснем, наприклад:
- 2Mg + O2 → 2MgO;
- C + O2 → CO2;
- Si + O2 → SiO2;
- 4P + 5O2 → 2P2O5;
- 2Fe(OH)3
 Fe2O3 + 3H2O;
Fe2O3 + 3H2O; - CaCO3
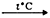 CaO + CO2;
CaO + CO2; - H2SiO3
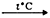 SiO2 + H2O;
SiO2 + H2O; - Ca(OH)2
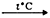 CaO + H2O;
CaO + H2O; - 2AgNO3
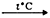 2Ag + 2NO2 + O2;
2Ag + 2NO2 + O2; - 2H3BO3
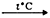 B2O3 + 3H2O.
B2O3 + 3H2O.
- 4NH3 + 5O2
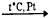 4NO + 6H2O;
4NO + 6H2O; - 2CdS + 3O2 → 2CdO + 2SO2,
- 2SO2 + O2
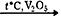 2SO3;
2SO3; - Fe2O3 + CO
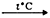 2FeO + CO2;
2FeO + CO2; - 2NO2 + O3 → N2O5 + O2;
- CO2 + C ↔ 2CO.
- 2HNO3 + P2O5 → N2O5 + 2HPO3;
- 2HClO4 + P2O5 → Cl2O7 + 2HPO3.
- Na2CO3(т.) + SiO2(т.) → Na2SiO3(т.) + CO2(г.)↑.
- 2HgO + 2Cl2 → ClHgOHgCl + Cl2O;
- NH4NO3 → N2O + 2H2O.
Список використаної літератури
- Загальна та неорганічна хімія: Підручник для студ. вищ. навч. закл. / О.М. Степаненко, Л. Г. Рейтер, В. М. Ледовських, С.В. Іванов. - К.: Пед. преса, 2000. - 784 с.: іл. ISBN 966-7320-13-8